باتری منبعی از انرژی پتانسیل الکتریکی است که در درون آن با انجام واکنشهای شیمیایی، انرژی شیمیایی به انرژی الکتریکی تبدیل میشود، این انرژی در قطبهای باتری قابل دریافت است. انرژی قابل دریافت در قطبهای باتری به ازای واحد بار الکتریکی را نیروی محرکه الکتریکی Electromotive force یا emf باتری میگویند و آن را با یکای ولت اندازهگیری میکنند. قطب مثبت باتری را آند و قطب منفی آن را کاتد مینامند. (درفرهنگ عامیانه به قطبها، سر مثبت و سر منفی نیز گفته میشود.)
انواع باتریها:
باتریها انواع گوناگونی دارند. باتری خشک، باتری نیکل کادمیوم (Ni-Cd)، باتری لیتیوم (Li)، باتری اسیدی، سلول های الکترو شیمیایی و باتری خورشیدی از انواع باتریها هستند. کاربرد باتریها برای فعّال کردن مدار است به طوری که تمام مدارهایی که با باتری کار میکنند، بدون باتری باید دور انداخته شوند (مثل ساعت، تلفن همراه و…).
عملکرد کلیهی باتریها تقریباً مشابه یکدیگر است. پس با فهم آن چه درون یکی از آنها رخ میدهد، میتوان به درک مناسبی از شیوه ی کار کلیهی باتریها دست یافت. ما طرز کار باتری روی – کربن را توضیح میدهیم. این باتری یکی از سادهترین باتریهایی است که میتوان ساخت و گاهی آن را "باتری استاندارد کربنی" نیز مینامند.
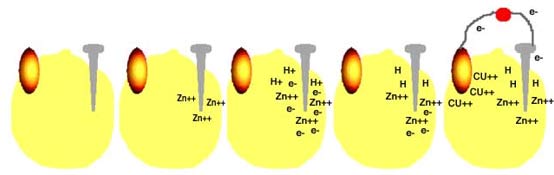
فرض کنید ظرفی حاوی اسید سولفوریک داریم. اگر میلهای از جنس روی را در این محلول قرار دهید، اسید شروع به خوردن روی میکند. حبابهای هیدروژن روی میله ظاهر میشود و محلول در اثر حرارت حاصل از واکنش شیمیایی، گرم خواهد شد. آن چه روی میدهد، تقریباً به ترتیب زیر است:
حال اگر میلهای از جنس کربن نیز در محلول قرار دهید ( اسید روی این میله اثری ندارد.) و آن را با سیم به میلهی اول متصل کنید، شرایط تغییر میکند و به صورت زیر درمیآید:
با گذشت زمان، میلهی روی کم کم در اسید حل میشود و یونهای هیدروژن موجود در محلول نیز به تدریج مصرف میشوند، تا این که سرانجام باتری تمام میشود.
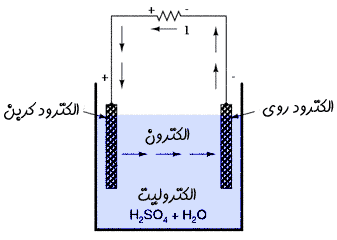
به دو میلهی به کار رفته در باتری، اصطلاحاً " الکترود " میگویند.
محلول حاوی یون ( در مثال بالا اسید سولفوریک ) نیز " الکترولیت " نامیده میشود.
در باتریای که شما ساختهاید، اتفاقاتی که روی میدهد بسیار شبیه مراحل بالاست. این مراحل در شکلهای زیر نشان داده شده است.